Para ensinar a tabela periódica de uma forma diferente!
quinta-feira, 16 de dezembro de 2010
segunda-feira, 6 de dezembro de 2010
Halaven, quão "simples" deve ser um fármaco?
Saiu na Nature News: No último dia 15 de novembro o FDA aprovou a comercialização do Halaven (mesilato de eribulina), para o tratamento do cancer de mama. O motivo para essa notícia estar aqui nesse espaço é a estrutura dessa substância, trata-se de um análogo "simplificado" da Halicodrina B
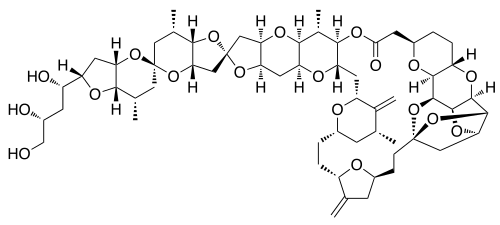
A Helicodrina B foi isolada pela primeira vez em 1986 e sua primeira sintese total foi realizada por Kishi e colaboradores em 1992, à essa época Kishi relatou não estar muito interessado nas propriedades farmacológicas da substância e sim na utilização da sua metodologia de formar novas ligações C-C (reação de Nozaki–Hiyama–Kishi)
Este medicamento é um triunfo para síntese orgânica. Apesar de "simplificada" a substância comercializada possui 19 estereocentros e é sintetizada em mais de 60 etapas! A indústria não encararia um desafio destes à toa, estima-se que se aprovada para o tratamento de outros tipos de cancer o helaven movimentará o mercado farmacêutico na casa de 1 bilhão de dólares!
O Halaven é um exemplo de que complexidade estrutural não é mais tabú e serve para derrubar vários mitos. e que quando o negócio é lucro a indústria banca!
A propósito, quem disse mesmo que fármaco tem que ser planar e sem centros quírais?
Em tempo: Aproveitando o embalo da reportagem da science sobre a ciência brasileira, lanço os seguintes questionamentos: Como anda a síntese orgânica brasileira? Quão longe estamos da fronteira? Porque não nos arriscamos em projetos mais ousados? Será somente pela falta de recursos?
As respostas a estes questionamentos não são simples e não tenho a menor pretenção de respondê-los, mas acho que essa discussão deve passar desde a quantidade de grupos de síntese orgânica existentes no país até a lógica de fomento para essa ciência, que julgo possuir papel estratégico no desenvolvimento do país.
terça-feira, 16 de novembro de 2010
Solventes Secos: Será que peneira molecular é realmente milagrosa?
Este assunto já está ficando recorrente nesse blog, mas como eu não me conformo em perder um tempo absurdo secando solvente, sempre que vejo uma novidade acho interessante compartilhar. Desta vez a dica foi do meu amigo Danilo. Saiu um JOC que põe em xeque as maneiras tradicionais de secagem de solvente. Segundo este trabalho, THF em contato com peneira molecular (3A) por 72 horas é o suficiente para deixa-lo com menos água que o método tradicional (Na e benzofenona)
Se esses números estão realmente corretos, eu não sei, pois não tenho nem glovebox nem um Karl Fischer para repeti-los, mas certamente vou tentar usar o THF tratado deste jeito para ver se funciona. Mas mesmo funcionando a cor azul do THF tratado tradicionalmente tem um efeito psicologico trememndo, vocês não concordam?
Além de THF este método é aplicado à outros solventes como diclorometano e metanol.
terça-feira, 2 de novembro de 2010
Videoblog: Preparação de Diazometano
Este vídeo é o primeiro de uma série de vídeos que eu pretendo postar sobre alguns procedimentos experimentais que regularmente encontro pessoas com dúvidas (principalmente os iniciantes). A intenção é totalmente didática. Coisas que parecem simples (para quem já sabe) as vezes pode parecer complicadas para quem nunca fez!
Alguns procedimentos experimentais nos laboratórios de síntese orgânica são realmente perigosos, e muitas vezes assustam muita gente, contudo sendo tomados os devidos cuidados qualquer procedimento pode ser realizado (mas nem sempre tranquilamente!). A preparação de diazometano é um destes procedimentos. Me lembro bem do meu primeiro estágio de iniciação científica quando uma amiga precisou preparar este reagente, e a galera ficou apavorada. Qual o motivo deste medo? Diazometano é um gás bastante tóxico e potencialmente explosivo, daí o medo da galera. Geralmente utilizado como solução etérea, diazometano é um regente bastante útil, em laboratórios de química de produtos naturais onde é comumente utilizado para metilação in situ de ácidos carboxílicos para análise por cromatografia gasosa. Dos muitos usos em síntese orgânica destaco seu uso como reagente de esterificação e na preparação de diazocetonas, grupo funcional extremamente versátil.
Devido a sua instabilidade e toxicidez, diazometano não é normalmente estocado sendo utilizado logo após sua preparação.
A maioria dos precursores do diazometano contém o grupo funcional N-metil-N-nitros (sendo o mais comum o Diazald), que gera o diazometano durante o tratamento com base.
Para preparação de diazometano estão disponíveis aparelhagens especiais apropriadas que "garantem" a segurança do processo. O diferencial destas vidrarias é a ausência de juntas esmerilhadas e no lugar destas juntas polidas, pois o atrito entre as juntas pode provocar a explosão do reagente. Estes equipamentos estão disponíveis em vários tamanhos, mas o mais comum é o mostrado abaixo, com o qual pode ser produzido quantidades reduzidas de diazometano.
Outras montagens são possíveis, como mostrado abaixo:
No vídeo estou utilizando um semelhante a este último, onde geralmente preparo de 100 a 250 mL da solução etérea de diazometano. Protocolo experimental pode ser encontrado no organic syntheses.
Geralmente o diazometano é usado em excesso, contudo é possível saber a concentração facilmente por titulação indireta com ácido benzóico. Já se for preciso utilizar a solução de diazometano seca a literatura diz para colocar algumas lentilhas de KOH na solução, mas pela minha experiência não adianta muita coisa!
É isso, com cuidado, sem medo e com segurança é possível realizar qualquer procedimento no laboratório.
Em tempo 1: Não é mais vendido Diazald para o Brasil, ou seja quem tem tem, quem não tem se sacode (prepara o reagente).
Em tempo 2: A estatística (lenda) diz que a cada 100 preparações de diazometano uma explode... Bem já fiz umas 20 vezes... então minhas chances estão diminuindo!!!!
quarta-feira, 6 de outubro de 2010
Mais um Nobel para síntese orgânica
Falar aqui que a síntese orgânica é importante, é chover no molhado. Mas a cada Nobel para a área, a visibilidade desta ciência aumenta. O nobel deste ano na minha opinião foi mas do que merecido. Acoplamentos cruzados são ferramentas indispenaveis na síntese orgânica moderna. A aplicabilidade destas metodologias vai da preparação de moléculas bioativas à materias semicondutores. Particurlamente tenho um carinho especial com essa química pois parte da minha formação sintética foi feita em cima dessa química, que considero extremamente rica.
Não esqueçam que o Suzuki estará ano que vem no Brasil para o Bmos!
Só fico curioso com o que achou um "Velho" amigo meu sobre este Nobel, pois segundo ele Suzuki é marca de moto.
segunda-feira, 4 de outubro de 2010
Maquina de secagem de solventes, sonho de consumo de quase todos os sintéticos.
Imagina não ter que perder tempo secando solventes. Isto é possível! A empresa americana Glass Contour oferece um equipamento fantástico para a tarefa que demanda bastante tempo, tempo que para quem trabalha com síntese quase sempre é precioso. Já conversei com pessoas que usaram, (lá fora, óbvio), que me disseram que é uma maravilha. Por aqui por enquanto ninguém tem. É claro que barato não é, (não sei o preço, o site não fornece), mas sei que tem muito "chefe" que virá com aquela história insuportável: Na minha época eu não tinha isso...
Molécula postada no blog, comentada na Nature chemistry
Recentemente postei a síntese da (+)-Fastigiatina feita pelo grupo do Matthew D.Shair publicada no JACS, e este trabalho foi alvos de críticas positivas no nature chemistry. A utilização de metodologias clássicas, como reação de Mannich e a inspiração das desconexões baseadas na biosíntese são os pontos ressaltados na crítica. Realmente o trabalho é muito bom. Sigo acompanhado o trabalho do Matthew D.Shair, e em breve postarei outras sínteses interessantes.
sábado, 25 de setembro de 2010
Organic Chemistry Resources Worldwide
O portal organic-chemistry.org é bastante conhecido, mas encontrei recentemente uma outra fonte de informação sobre química orgânica e afins bastsante interessante. É o Organic Chemistry Resources Worldwide que além de informações e línks úeis à comunidade sintética, traz uma seção de oportunidades de trabalho, onde podem ser encontrados diversas oportunidades de pos-doc. Vale apena conferir
quinta-feira, 23 de setembro de 2010
Oxidação com NaH, a saga continua.
Quem acompanha a literatura deve se lembrar que na metade do ano passadao foi publicado um JACS onde álcoois eram oxidados utilizando NaH!
O fatídico artigo causou reboliço, com direito a um liveblogging no Totallysyntetic (que eu acompanhei ao vivo!). Tanto se falou no assunto que os editores do JACS retiraram o artigo da revista.
Pois bem, essa semana acaba de saír um TL de um grupo coreano, muitíssimo parecido (para não dizer idêntico), onde é utilizado o mesmo protocolo do JACS dos chineses na oxidação de benzoínas (2 eqv de NaH em THF). E o que chamou muita minha atenção é que os chineses do JACS não foram citados pelos coreanos! Pelo menos neste artigo eles levam em consideração o papel do oxigênio neste processo. É bem verdade que esse mecanismo é meio esquisito, mas pelo menos não foi proposto a maluquice que foi proposta no JACS dos chineses.
Mas a informação mais bizarra a meu ver, é o fato de que foi utilizado THF desoxigenado e ainda foi observado o produto de oxidação...
Para mim essa transformação bizarra não acontece sem oxigênio, ou seja esse THF ainda tinha O2 dissolvido! Na verdade o oxidante é o O2 e não o NaH! Uma alternativa mais plausível para esse mecanismo é um mecanismo radicalar, onde o átomo de H deve sair como radical H tendo o O2 como aceptor.
Acho que novamente os referees paparam mosca. Um simples experimento na presença de um trapeador de radicais livres poderia dar informações a respeito do mecanismo radicalar.
Vamos esperar para ver como esta história acaba... mas como TL não é JACS talvez não tenha estardalhaço.
sexta-feira, 17 de setembro de 2010
Terminologias precisas em estereoquímica
Estereoquímica é uma parte complicada da química orgânica e que muitas vezes pode derrubar muita gente boa. E a confusão feita com algumas terminologias podem gerar equívocos importantes. Muitas afirmações presentes em livros de graduação não estão completamente corretas. Devemos lembrar que a estereoquímica é fundamentada na teoria de grupos e simetria, temas nem sempre dominado por químicos orgânicos... Não é comum encontrarmos confusão entre centro estereogênico e centro quiral. Visando elucidar essa confusões recomendo a leitura do trabalho publicado no Journal of Chemical Education em 2006. (Precision in Stereochemical Terminology). Neste trabalho encontramos várias correções feitas a afirmações comumente encontradas em livros didáticos de química orgânica.
domingo, 5 de setembro de 2010
terça-feira, 24 de agosto de 2010
(+ )-Fastigiatina
A despeito da importância biológica, alcaloides pentacíclicos com estrutura truncada são um grande desafio do ponto de vista sintético. Essas estruturas não são facilmente visualizadas no papel sendo os modelos de química de grande ajuda na concepção das desconexões destas. Este JACS, publicado pelo grupo do Matthew D.Shair, traz uma abordagem biomimética, inspirada na biossíntese do alcaloide lycodine.
A desconexão principal da abordagem é entre C13 e C4 via uma reação de Mannich transanular. A flexibilidade da rota me chamou atenção, pois a partir do intermediário 5 seria possível vários caminhos alternativos para construção do esqueleto do intermediário avançado.
Na etapa de ciclização ( de 14 para 16) temos um exemplo bastante ilustrativo da importância da utilização de grupo de proteção, onde o grupo nosil foi fundamental no processo de ciclização.
O esqueleto pentaciclico do alvo final foi obtido pelo aquecimentode 16 em trifluoroetatol, o processo de ciclização passa primeiramente or uma retro-aldol, seguida pela formação do íon imínium e posterior reação de Mnnich transanular. Os autores conjecturam que a facilidade do processo de ciclização, sugere que um intermediário tipo 4 pode estar envolvido no processo biossintético. Pode até ser... Mas acho que a disposição espacial dos grupos e a conformação amarrada não deixa muita opção para que aconteça outra coisa.
E por fim descarboxilção e acetilação completa a síntese da (+)-Fastigiatina em 15 etapas e em 30% de rendimento global.
segunda-feira, 9 de agosto de 2010
SN2 em carbono terciário, quebrando paradigmas!
Aprendemos nas disciplinas de química orgânica que em carbono terciário alquílicos substituiçãoes nucleofílicas são do tipo Sn1, ou seja passam por carbocátion!
Mas esse paradigma foi quebrado recentemente. Saiu no JACS um trabalho ondo no sistema 1,4,7-trimetiloxatriquinano ocorre Sn2, em carbono terciário, comprovado por estudo cinético!
Talvez seja a exceção que confirma à regra!
quinta-feira, 5 de agosto de 2010
Excelente exemplo da importância da síntese orgânica!
Extraído do Blog: Química de produtos naturais
E viva a síntese orgânica!
"Mycobacterium tuberculosis é o agente patogênico causador da tuberculose pulmonar. Cerca de 1/3 de toda a população mundial está infectada com M. tuberculosis. A forma de tratamento é a administração de antibióticos durante 6 meses, de forma ininterrupta. A interrupção deste tratamento pode levar ao desenvolvimento de resistência por parte do M. tuberculosis, tornando a cura praticamente impossível. Existem poucos antibióticos para tratar tuberculose. Por isso, existe um grande interesse na descoberta de novas formas de tratamento desta doença.
Artigo publicado no Journal of the American Chemical Society no fim do ano passado apresentou o isolamento de um composto chamado de edaxadieno, um metabolito secundário produzido por Mycobacterium tuberculosis. Não cabe aqui a explicação de como os autores chegaram a esta descoberta (que está descrita no artigo de Mann et al., 2009). E sim mostrar um erro primário que os autores cometeram.
A estrutura apresentada para o edaxadieno é a ilustrada a seguir, com o deslocamento químico de RMN 13C assinalado para o carbono 13 (C-13). O deslocamento químico deste carbono é de δ 72,9. Valor alto para um carbono quaternário substituído por 4 carbonos. Mas, os autores indicaram no material suplementar do artigo que existe uma correlação à longa distância entre o grupo metilideno terminal (=CH2) e o carbono C-7. Evidentemente que tal correlação só se justifica se o grupo metilideno estiver “conectado” ao anel central da estrutura.
Porém, como justificar o deslocamento químico de δ 72,9 de C-13?
Quando se desenha a estrutura do edaxadieno com o programa ChemDraw e se utiliza a ferramenta de simulação de deslocamento químico de 13C para os carbonos da estrutura, obtém-se os valores que estão indicados na estrutura a seguir (à direita). Nota-se que o valor do deslocamento químico de 13C do carbono C-13 é bem diferente do atribuído pelos autores: δ 40,5. Nota-se, ainda, que as diferenças de deslocamento químico mais pronunciadas são aquelas atribuídas aos carbonos 7, 8, 9 e 13. A análise por espectrometria de massas de alta resolução do composto isolado de M. tuberculosis indicou a fórmula C20H32, compatível com a fórmula do edaxadieno. A estrutura do edaxadieno foi publicada como sendo de um esqueleto de carbono totalmente inédito.
Meses depois, os mesmos autores publicaram artigo na revista Organic Letters, argumentando que a biossíntese do edaxadieno não parecia ser plausível. E que, além do mais, se fosse considerada a estrutura indicada a seguir para o produto natural isolado de M. tuberculosis, este composto poderia facilmente desidratar durante a análise por espectrometria de massas, levando à formação do íon [M-H2O]+, de fórmula C20H32. Os autores sintetizaram o composto indicado a seguir, conhecido como nosibercol (originalmente isolado de uma esponja marinha, Raspaillia sp. Ver Rudi et al., 2004). E verificaram que este era idêntico ao composto isolado de M. tuberculosis. Mais recentemente, os autores do artigo original de isolamento publicaram uma errata no Journal of the American Chemical Society (Mann et al., 2010).
Mais recentemente, Spangler et al. (2010) sinetizaram dois compostos modelo para testar a hipótese estrutural do edaxadieno. As estruturas estão indicadas a seguir. Como pode se verificar, os deslocamentos químicos dos carbonos correspondentes ao carbono 13 da estrutura do edaxadieno concordam MUITO BEM com o valor calculado para a suposta estrutura do edaxadieno (ver acima, a simulação com o programa ChemDraw).
Quais lições pode-se tirar desta história?
Analise seus dados experimentais com muito cuidado. Qualquer incompatibilidade com dados que seriam esperados (por modelagem, como, por exemplo, utilizando o programa ChemDraw) deve ser analisada com muito mais cuidado, antes de se tomar uma decisão definitiva, neste caso, de se propor uma estrutura química totalmente inédita. Em caso de dúvida, é melhor testar outras hipóteses.
Este é um bom exemplo para se utilizar em aula de análise estrutural avançada de compostos orgânicos. Ou para se demonstrar o valor da síntese orgânica para se comprovar propostas estruturais"E viva a síntese orgânica!
domingo, 18 de julho de 2010
"Lá fora" a coisa está preta!
O editorial da última edição da Organic Process Research & Development chamou minha atenção. Com o título "Is there a Future for Organic Chemists in the Pharmaceutical Industry outside China and India?" é chamada a atenção para o número de industrias que estão sendo fechadas ou transferidas na europa e nos EUA. Fico imaginando, se a coisa está ruim lá, imagina aqui! então fica a pegunta: Existe futuro para químicos orgânicos no Brasil?
terça-feira, 13 de julho de 2010
Química pela química!
Direto do Totally synthetic.com... Artigo bastante interessante, mas o que eu mas gostei nõa foi da química e sim a motivação para fazer a molécula! "Although urechitol A itself exhibited no biological activity, its unique tetracyclic structure prompted us to investigate its synthesis".
Fica a pergunta, um projeto desses sem o blá-bla-ba de atividade biológica seria aprovado por nossos órgãos de sofrimento fomento?
quinta-feira, 8 de julho de 2010
Aplykurodinone 1
Pela terceira vez Paul Docherty (Totally sinthetic) sai na minha frente e posta a mesma molécula que estava preparando para postar... menos trabalho p/ mim! Aplykurodinone 1 é um esteroide com pronunciada atividade antitumoral, e foi preparado pelo grupo do Danishefsky, publicado no JACS(DOI: 10.1021/ja1035495) mês passado. Vale apena conferir o Post na coluna chemistry world da RSC e também o trabalho. Chamo atenção para a estratégia para controlar a esterioquímica de C8.
sexta-feira, 18 de junho de 2010
Quais os requisitos para uma síntese ideal?
Phil Baran tenta responder a pergunta acima no JOC perspective (DOI: 10.1021/jo1006812) que está no ASAP desse mês.
Eis algumas moléculas analizadas. Reparem que foram feitas apenas nos últimos 7 anos!
Segundo esse conceito ele ranqueia as sínteses:
Não esqueçam que esse caboclo estará no próximo BMOS!!
Baseado nas idéias de Hendrikson de 1975 do que seria uma síntese ideal, Phil Baran analiza as sínteses totais realizadas em seu laboratório nos últimos 7 anos na ótica da idealidade. Tem até um % de idealidade!
Eis algumas moléculas analizadas. Reparem que foram feitas apenas nos últimos 7 anos!
Segundo esse conceito ele ranqueia as sínteses:
Não esqueçam que esse caboclo estará no próximo BMOS!!
Borohidreto de sódio+Iodo, ótima combinação para reduzir ácidos carboxílicos!
Para os mais cascudos esse post pode ser besta, mas como tem muito novato acompanhando o blog, acho interessante esse post.
Classicamente para reduzir ácidos carboxílicos aos álcools correspondentes utilisamos hidreto de lítio e alumínio, o que geralmente funciona muito bem, contudo a disvantagem é o preço! (100 g R$ 597,00).
Recentemente estava tendo resultados ruins na redução da prolina ao prolinol utilizando a metodologia classica com hidreto de lítio e alumínio, então lembrei-me de que uma vez um camarada meu disse que borohidreto de sódio faz milagres... Então utilizei uma metodologia meio antiga para redução de ácidos utilizando borohidreto de sódio na presença de Iodo molecular. O que resolveu totalmente meu problema e ainda com a vantagem de ser um pouco mais barato (100g R$ 396). Mas preços a parte no meu caso a reação foi bem mais limpa!
Abaixo o mecanismo proposto no artigo original:
O que ocorre é a gerção da borana in situ.
segunda-feira, 14 de junho de 2010
Reator fotoquímico em fluxo.
ASAP do TL. Pesquisadores da Abbott desenvolveram uma engenhoca bastante interessante, um reator fotoquímico em fluxo, apesar dos resultados demonstrados não serem muito gerais, a engenhoca tem potencial.
sexta-feira, 11 de junho de 2010
Capa do Blog: Diazonamide A
quinta-feira, 10 de junho de 2010
Acetona e peneira molecular!!
Post bastante interessante a respeito da combinação de Acetona e peneira molecular, postado no blog curlyarrow
terça-feira, 25 de maio de 2010
Tamiflu Sem azida
Já foi tempo em que me impressionava com moléculas gigantescas... É claro que são desafiadoras, contudo tem muita "molequinha" que dá muito trabalho. Um bom exemplo é o Oseltamivir, vulgo Tamiflu. Obviamente que a importância que a molécula apresenta motiva a busca de melhores estratégias para prepara-la. Recentemente foi publicado um Chemical Reviews a respeito das abordagens sintéticas para preparação desta importante molécula.
Mês passado um grupo chinês publicou um JOC com uma abordagem bastante elegante (com 11 etapas e utilizando D-tartarato como material de partida) para síntese do Tamiflu, onde o principal destaque é a ausência do uso de azida, o que traz benefícios na aplicação em escala industrial, visto o potencial explosivo de azidas!
O nitroaldeído, intermediário chave no processo de ciclização foi preparado em 9 etapas.
A abordagem de ciclização é bastante elegante, uma reação de de Michael e HWE em cascata onde o esqueleto ciclico do oseltamivir é preparado em uma única etapa. O diastereoisômero 5S é transformado diretamente no tamiflu pela redução do grupo nitro, já o outro diastereoisômero pode ser convertido na molécula desejada aplicando-se a estratégia de Hayashi, o que torna o processo bastante atraente do ponto de vista industrial.
terça-feira, 23 de março de 2010
Amos Smith III em dose dupla no OL, belo exemplo de FOS e DTS
Esta semana Amos Smith III atacou em dose dupla no OL. Primeiro com um trabalho sobre aranjo conformacional da (+)-Spongistatin 1, e baseado neste e em outos dados adquiridos a respeito da atividade biológica de outros análogos, foram propostos dois novos análogos.

Para produção destes, foram utilizados fragmentos da rota descrita por Amos Smith III em um OL de 2008 em uma rota de aumento de escala onde foi produzido 1,009 g da ditacuja. Este trabalho, por sinal, merece ser lido com atenção, para quem gosta de síntese vai ter referência para ler por quase um mês (que é o meu caso).Dos dois análogos propostos, um deles teve atividade comparada ao PN, na faixa de nanomolar. Enquanto o outro demonstrou que os espirocetais são fundamentais na atividade.
Para ques gostou do post sobre DTS e FOS este trabalho é um prato cheio!

Para produção destes, foram utilizados fragmentos da rota descrita por Amos Smith III em um OL de 2008 em uma rota de aumento de escala onde foi produzido 1,009 g da ditacuja. Este trabalho, por sinal, merece ser lido com atenção, para quem gosta de síntese vai ter referência para ler por quase um mês (que é o meu caso).Dos dois análogos propostos, um deles teve atividade comparada ao PN, na faixa de nanomolar. Enquanto o outro demonstrou que os espirocetais são fundamentais na atividade.
Para ques gostou do post sobre DTS e FOS este trabalho é um prato cheio!
quarta-feira, 17 de março de 2010
Function-Oriented Synthesis (FOS)
Seria muito bom se conseguíssemos criar moléculas com atividades farmacológicas importantes, utilizando apenas reações simples e em pouquíssimas etapas. No entanto para o tratamento de certas patologias os anos vem mostrando que as abordagens tradicionais da química medicinal precisam ser revistas. Um exemplo bastante ilustrativo, foi a explosão na década de 90 da química combinatória e a produção de bibliotecas gigantescas de moléculas. mas esta abordagem não gerou leads importantes por exemplo para o tratamento do câncer e de doenças auto-imunes. Nesta abordagem muitas vezes parte-se de núcleos de fácil acesso e de rápida derivatização. O reflexo deste fracasso é a importância que cada vez mais tem se dado a arcabouços de produtos naturais (PN). Em um artigo do Danishefsky no JOC ele coloca um ponto importante a esse respeito. Os organismos produzem metabólitos para interagirem com biomacromoléculas, por tanto a chance de encontrar atividade em PN é muito alta, o que pode ser constatado todo mês olhando rapidamente as principais revistas de química, onde sempre novas substâncias são isoladas e testadas para as mais diversas atividades.
É neste ponto que surge o conceito de Function Orieted Synthesis (FOS). Este conceito é apresentado de uma maneira bastante ilustrativa em um artigo do PAUL A. WENDER publicado em um Acc. Chem. Res. de 2007.
Apesar de vários PNs possuírem atividades extraordinárias seu uso e mesmo seu estudo torna-se proibitivo devido dificuldade de acesso a quantidades adequadas, quer seja por isolamento ou por síntese. É óbvio que com uma rora de 70 etapas torna bastante difícil o acesso a determinada substância, mesmo que ela seja "mágica". Nesse ponto o conceito de FOS prevê o desenvolvimento de análogos mais simples baseados nos grupos farmacofóricos presentes no PN, em economia de etapas e consequentemente estratégias inovadoras para tal.
PAUL A. WENDER chama a atenção de como nossa capacidade de sintetizar PN cresceu, mas esse crescimento não vai de encontro com a capacidade de suprir a demanda por esses produtos, onde surge o desafio para criatividade dos sintéticos em elaborar abordagens mais eficientes.
Destaco o caso da Briostatina, uma molécula extremamente complexa com atividade anti-tumoral excelente, contudo sua síntese possui mais de 70 etapas e sua obtenção de fontes naturais é extremamente limitada (0,00014%). A partir da rota de síntese foi possível desenvolver eficientemente mais de 40 análogos que preservaram a atividade. O desenvolvimento de uma rota convergente foi fundamental para o sucesso do planejamento. Foi desenvolvido uma metodologia de macrotranscetalização com desproteção global e fechamento seletivo do anel B.
Esta abordagem vai de encontro com o conceito de diverted total synthesis (DTS), apresentado no artigo do Danishefsky.
Esta abordagem vai de encontro com o conceito de diverted total synthesis (DTS), apresentado no artigo do Danishefsky.
É verdade que os análogos ainda são relativamente complexos, mas apresentam rotas factíveis, e são indispensáveis para o entendimento da atividade do PN original e abrem caminho para a tentativa de desenvolvimento de moléculas ainda mais simples .
Outros exemplos também são apresentados, como o caso do Laulimalide, onde um dos problemas a ser contornado é a labilidade da molécula que transforma-se muito facilmente no isolaulimalide.
Este trabalho mostra a INQUESTIONÁVEL importância da síntese total de PN para o desenvolvimento humano. (Mas será que alguém ainda tem dúvida?!!)
Assinar:
Postagens (Atom)



















































